|
|
 Metales 3 Metales 3

Bajo el microscopio, la estructura reticular se puede ver después de que la superficie haya sido tratada en consecuencia. No solo los átomos simples o los iones pueden formar redes cristalinas, sino también las
moléculas y sus grupos. Además, la formación de cristales no se limita únicamente a los metales, como ya muestra el ejemplo de los cristales de hielo. El término "cristalino" implica solo un orden en la estructura. Esto
puede referirse a subáreas o una estructura general.

'Cristalización' significa que los átomos se ordenan en cierta forma bajo ciertas condiciones. En el ejemplo anterior, un átomo está dispuesto en cada esquina de un cubo, pero no tiene una importancia particular para los
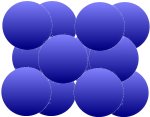
metales que nos interesan en este capítulo. Estos incluyen, por ejemplo, wolframita (W), cromo (Cr), tantalio (Ta), niobio (Nb) y molibdeno (Mo), que están dispuestos como se muestra en la imagen abajo. Las densidades
de empaque son del 68 por ciento en la parte superior y del 74 por ciento en la parte inferior.

| Átomo adicional en la intersección de la diagonal del espacio |
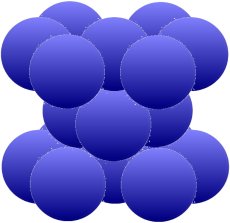
La red también se denomina cúbica centrada en el espacio, lo que puede entenderse mejor comparándola con la red cúbica centrada en la cara que aparece abajo. Este se puede existir en cobre (Cu), níquel (Ni), aluminio
(Al), plata (Ag) y oro (Au). Primer resultado: Estos dos arreglos permiten un paquete mucho más compacto que el primero de arriba.
| Átomos adicionales en las intersecciones de los diagonales de superficie |
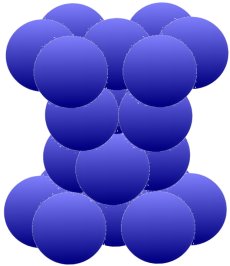
La siguiente estructura permite la misma densidad de empaque del 74 por ciento. En esta ocasión se consigue mediante una disposición hexagonal alrededor de un átomo. Entremedio hay uno (imagen de abajo) o dos
(imagen de abajo) grupo(s) de tres, que también se acercan entre sí y llenan al menos tres de los seis huecos.
La disposición anterior es, por ejemplo típica para magnesio (Mg), zinc (Zn), circón (Zr) y cadmio (Cd). El hierro (Fe) tan importantes para nosotros pero también el titanio (Ti), el cobalto (Co), el estaño (Sn) y el manganeso
(Mn), pueden formar diferentes estructuras reticulares dependiendo de la temperatura. Debajo, se agrupan dos grupos de tres, torcidos 120° entre sí, entre los anillos hexagonales. Debajo, se agrupan dos grupos de tres,
torcidos 120° uno contra otro, entre los anillos hexagonales.
Los metales se organizan en estas estructuras reticulares cuando, por ejemplo, cambian de estado líquido a sólido cuando se enfrían. Los líquidos son básicamente desordenados. Pero dado que siempre hay diferentes
núcleos de cristalización al inicio de la dureza, las estructuras formadas de esta manera rara vez encajan entre sí. Los errores en las ubicaciones de la red siempre se encuentran en las llamadas 'estructuras reales'.
Sin embargo, los errores también son posibles dentro de una sola estructura de red, por ejemplo cuando un espacio de red no está ocupado. Cuanto más alta es la temperatura, más frecuentes son estos errores.
Técnicamente, los defectos de la red pueden suponer una mejora, pero también un perjuicio en cuanto a las propiedades requeridas. Es por eso que existe el deseo de influir en las propiedades. Esto se llama tratamiento
térmico, que no sólo implica la refrigeración, pero también puede incluir un aumento de la temperatura entretanto, por ejemplo, durante el templado.
|
|