 Metales 4 Metales 4
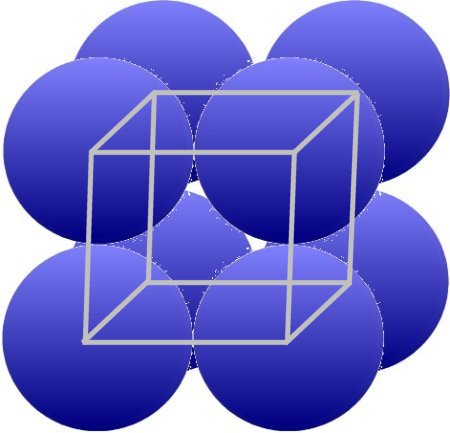
No siempre es suficiente representar la estructura de los metales, como se puede ver en el capítulo Metales 3. Solo se puede crear una red real si los centros de las partículas individuales están conectados por líneas.
Esto da como resultado distancias en caso de metal de 0,25 - 0,5 nm (0,000 000 000 25 - 0,000 000 000 5 m).
Además de los diversos núcleos de cristalización ya mencionados, existe una gran cantidad de desviaciones y desorden en la estructura real, que también aumentan con la temperatura o, p. con deformación plástica.
Están divididos en sitios de red no ocupados u ocupados por átomos extraños o creados adicionalmente. Se dividen en sitios de red que no están ocupados u ocupados por átomos extraños o que se crean
adicionalmente.
Sin embargo, no queremos extendernos demasiado en el análisis estructural de las redes, sino simplemente echar un vistazo al proceso normal de enfriamiento del hierro (Fe) y las redes que ocurren en el proceso.
Estamos haciendo esto aquí inicialmente sin el carbono que a menudo se asocia con él. Así que veamos el enfriamiento desde 1536°C (δ-Fe).
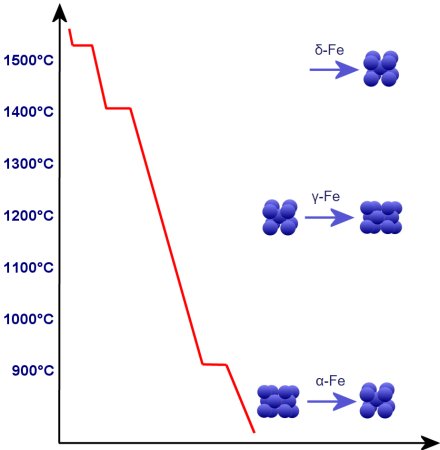
Aquí el Fe comienza a organizarse en forma de cristales con redes cúbicas centrado en el espacio. Por encima de 1.401°C, surge una mayor densidad debido a la disposición cúbica centrada en las caras (γ-Fe).
A partir de los 911°C se transforma en forma cúbica centrada en el cara (α-Fe). Entre 1401°C y 911°C δ-Fe se convierte en γ-Fe ya partir de 911°C γ-Fe se convierte en α-Fe.
Sin embargo, el espaciado de centro a centro de los átomos se vuelve mayor de δ- a γ-Fe e incluso más pequeña que en caso de γ-Fe, es decir, en conjunto, la densidad de empaquetamiento más
pequeña puede ser más que compensado. A partir de 911°C la conversión se dirige a α-Fe, cuya proporción aumenta.
Omitimos aquí la llamada temperatura de Curie de 769°C porque afecta las propiedades magnéticas del hierro pero no su formación de cristales, como se descubrió más tarde. Para esta temperatura de hasta 911°C se
pretendía originalmente el nombre β-Fe.
Echaremos un vistazo más de cerca con γ-Fe (austenita) y α-Fe (ferrita). El primero tiene propiedades favorables para reformar en caliente, por ejemplo, la forja. Aquí, sin embargo, abandonamos el puro
hierro y nos ocupamos del carbono y sus posibles inclusiones en la red cristalina de hierro.
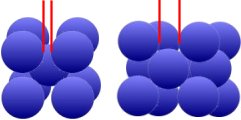
Como se puede ver en la imagen de arriba, en la red cúbica centrada en las caras de γ-Fe (austenita) hay más espacio entre los átomos de hierro de la derecha que en la red cúbica centrada en el espacio de
α-Fe (ferrita). La temperatura superior a 911°C favorece el almacenamiento de átomos de carbono.
|